Elaborado en Mayo 2022
Participan:
Sandra Sandoval Osorio, Liliana Tarazona Vargas, José Francisco Malagón Sánchez y Marina Garzón Barrios.
La relación que establece Faraday es: a deflexiones iguales de la aguja, corresponden cantidades iguales de sustancias descompuestas, en tiempos iguales, sin que la fuente de electricidad tenga incidencia. De aquí la ley de Faraday:
- Cantidades descompuestas de una sustancia determinada son siempre proporcionales a las cantidades de electricidad que han pasado por esta.
- Los pesos de los elementos liberados de su combinación, en un tiempo dado, son proporcionales a los equivalentes químicos de estos elementos.
Para Ostwald (1912) esta ley constituye la primera concepción numérica, o cuantitativa, de un fenómeno electroquímico. Se tiene aquí un proceso de equivalencia que pone en términos de la cantidad de sustancia la cantidad de electricidad y viceversa.
- Las cantidades de sustancias asociadas a cantidades iguales de electricidad son químicamente equivalentes.
Podemos destacar los siguientes aspectos: Faraday encuentra que la descomposición electroquímica de las sustancias no dependía de la separación por la que pasaba la corriente en el electrolito, distancia entre los polos por los que entraba y salía la corriente:
Me esforcé por aplicar esta facilidad de transmitir la corriente de electricidad a través de cualquier longitud de un conductor, a una investigación de la transferencia de los elementos en un cuerpo en descomposición, en direcciones contrarias, hacia los polos (…) cuando un trozo de papel tornasol y un trozo de papel de cúrcuma se combinaban y humedecían en solución de sulfato de sodio, la punta del cable de la máquina (que representa el polo positivo) se coloca sobre el papel tornasol y el punto de recepción del tren de descarga, que representa el polo negativo, sobre el papel de cúrcuma, bastaron unas pocas vueltas de la máquina para mostrar la formación del ácido en el primero y el álcali en el último, exactamente de la manera efectuada por una corriente volta-eléctrica. (Faraday, 1849, p.128)
Si el contacto del punto de descomposición conectado con el tren de descarga se hizo con papel de cúrcuma tocando el conductor principal, o con otro papel de cúrcuma conectado a través de los setenta pies de cuerda, la mancha de álcali para un número igual de vueltas de la máquina tenía la misma intensidad de color. Los mismos resultados ocurrieron en el otro cable de descomposición, ya sea que se usara la sal o el yoduro; y se demostró completamente que esta gran extensión de la distancia entre los polos no produjo ningún efecto sobre la cantidad de descomposición, siempre que se pasara la misma cantidad de electricidad en ambos casos. (Faraday, 1849, p.129)
Este mismo resultado se encontró al conectar los papeles de cúrcuma y de tornasol con una cuerda humedecida en sulfato de sodio (o en yoduro de potasio) de una longitud de 4 pies, y con una longitud de 70 pies también encontró el mismo efecto (producción de ácido y álcali en el polo positivo y negativo respectivamente, las cantidades tampoco se vieron afectadas)
Cuando utilizaba una máquina eléctrica, un mismo número de giros daba cuenta de la misma cantidad de electricidad que transmitía al electrolito. De esta manera podía decir que los efectos de la electrodescomposición, es decir, la cantidad de sustancia descompuesta, dependía de la cantidad de electricidad en los polos.
El estudio de estas situaciones lo lleva a considerar la conducción de la electricidad en los procesos de descomposición, pues los polos podrían ser los alambres metálicos de la máquina eléctrica, o las placas metálicas que conformaban una batería. Además, la sustancia en descomposición (o electrolito como lo llama en la serie VII) también debe cumplir la condición de conducción.
El estudio del electrolito cobró importancia en el trabajo de Faraday, para explicar la descomposición química. Mientras que otros estudiosos de la electrodescomposición como Grotthuss, Davy, Hiffoult, Chomprè, Biot, M.A. de la Rive, consideraban que los polos ejercían acciones de atracción y repulsión sobre los componentes de las sustancias en descomposición y era esto lo que explicaba la producción de sustancias. Sus modelos respondían a la relación entre distancias y fuerzas definidas en la electrostática: la fuerza es proporcional al inverso del cuadrado de la distancia entre los polos. Para Faraday la atracción y repulsión entre los polos y las sustancias en contacto con éstos no da respuesta a la descomposición electroquímica. Con los experimentos en los que uno solo de los polos genera la descomposición, muestra que los electrolitos se descomponen y sus compuestos no necesariamente se acumulan sobre un polo. Lo que sí es necesario para que se dé la descomposición es la corriente (como lo describen los otros científicos).
Esa descomposición electroquímica no depende de ninguna atracción y repulsión directa de los polos (es decir, las terminaciones metálicas de la batería voltaica o las disposiciones de la máquina eléctrica ordinaria) sobre los elementos en contacto con ellos o cerca de ellos, parecían muy evidentes desde los experimentos realizados en el aire, cuando las sustancias producidas no se acumularon sobre ningún polo, pero, en obediencia a la dirección de la corriente, fueron producidas, y diría que se expulsaron, en las extremidades de la sustancia en descomposición. Pero a pesar de la extrema disparidad en el carácter del aire y los metales, y la diferencia casi total existente entre ellos en cuanto a su modo de producir electricidad y de cargarse con ella, tal vez aún se pueda afirmar, aunque hipotéticamente, que las porciones límite de aire eran ahora las superficies o lugares de atracción, como se suponía que eran los metales antes. Para ilustrar este y otros puntos, traté de idear un arreglo mediante el cual pudiera descomponer un cuerpo contra una superficie de agua, así como contra el aire o el metal, y logré hacerlo de manera excepcional. (Faraday, 1849, p.140)
Si los cables de un galvanómetro se terminan en placas, y estos se sumergen en ácido diluido, contenido en un recipiente de vidrio rectangular formado regularmente, conectado en cada extremo con una batería voltaica por polos iguales a la sección del fluido, una parte de la electricidad pasará por el instrumento y provocará una cierta desviación. Y si las placas se mantienen siempre a la misma distancia entre sí y desde los lados del recipiente, siempre son paralelas entre sí y se colocan de manera uniforme en relación con el fluido, entonces, si están sumergidas cerca del medio de la solución de descomposición, o en un extremo, todavía el instrumento indicará la misma desviación y, en consecuencia, la misma influencia eléctrica. (Faraday, 1849, p.144)
Faraday acude al galvanómetro para mostrar que en cualquier parte del circuito formado para la descomposición se tiene la misma influencia eléctrica sobre la sustancia.
Considerar la influencia de los polos (la distancia entre ellos y su naturaleza) le permite a Faraday concluir que: para una cantidad constante de electricidad, la cantidad de actividad electroquímica también es constante, independientemente de la disposición de los polos, siempre sería equivalente a un efecto químico estándar basado en la afinidad química ordinaria. (Faraday, 1849. 145).
Es así como antes de llegar a esta conclusión examina los diferentes factores que pueden influir. En los anteriores fragmentos se ha establecido esta relación entre las sustancias que se descomponen y la cantidad de electricidad involucrada. Los resultados que obtuvo le llevaron a concluir que las sustancias que pueden descomponerse, bajo la influencia de la corriente eléctrica, están formadas por cuerpos o sustancias simples; las cuales se encuentran en una proporción definida, que es la que siempre se genera en la acción electrolítica.
Para estudiar si existe alguna relación de equivalencia entre el tamaño de los electrodos y la descomposición de las sustancias por acción de la corriente eléctrica, procede de la siguiente manera:
El primer punto investigado fue la influencia o indiferencia de amplias variaciones en el tamaño de los electrodos, para lo cual se utilizaron instrumentos como los descritos anteriormente (709, 710. 711.). Uno de ellos tenía placas de 0,7 pulgadas de ancho, y casi cuatro pulgadas de largo; otro tenía placas de sólo 0,5 pulgadas de ancho, y 0,8 pulgadas de largo; un tercero tenía alambres de 0,02 pulgadas de diámetro, y tres pulgadas de largo; y un cuarto, alambres similares de sólo la mitad y una pulgada de largo. Sin embargo, cuando éstos se llenaban con ácido sulfúrico diluido y, al ser colocados en sucesión, una corriente eléctrica común pasaba a través de ellos, casi la misma cantidad de gas se producía en todos ellos. La diferencia estaba a veces a favor de uno y a veces del otro; pero el resultado general fue que la mayor cantidad de gases se produjeron en los electrodos más pequeños, es decir, los que consistían simplemente en alambres de platino. (Faraday, 1849, p. 209)
Para estudiar si existe alguna relación entre la descomposición de las sustancias y la clase de electrolitos se utilizaron soluciones de sustancias alcalinas, sales y también se podría incluir ácidos. Esta actividad se describe así:
Cuando las soluciones de potasa o sosa cáustica, o sulfato de magnesia, o sulfato de sosa, fueron sometidos a la corriente eléctrica, tanto el oxígeno y el hidrógeno se produjeron de ellos como del ácido sulfúrico diluido, con el cual fueron comparados. Cuando se experimentaba con una solución de amoníaco, convertida en un mejor conductor por sulfato de amoníaco (554.), o una solución de subcarbonato de potasa, el hidrógeno producido estaba en la misma cantidad que el liberado del ácido sulfúrico diluido con el que se comparaban. Por lo tanto, los cambios en la naturaleza de la solución no alteran la constancia de la acción electrolítica sobre el agua. (Faraday, 1849, p. 214)
Se examina también si cambiando la concentración del electrolito se afecta la magnitud de descomposición de las sustancias por acción de la corriente eléctrica.
El tercer punto, respecto al cual se probó el principio de igual acción electroquímica sobre el agua, fue variación de la fuerza de la solución utilizada. Para convertir el agua en un conductor, se le había añadido ácido sulfúrico (707.); y no parecía improbable que esta sustancia, junto con muchas otras, pudiera hacer que el agua estuviera más sujeta a la descomposición y que la electricidad siguiera siendo la misma en cantidad. Pero tal no fue el caso. El ácido sulfúrico diluido, de diferentes concentraciones, fue introducido en diferentes aparatos de descomposición y sometido simultáneamente a la acción de la misma corriente eléctrica (714.). Se produjeron ligeras diferencias, como antes, a veces en una dirección, a veces en otra; pero el resultado final fue que se descompuso exactamente la misma cantidad de agua en todas las soluciones con la misma cantidad de electricidad, aunque el ácido sulfúrico en algunas de ellas era setenta veces mayor que en otras. Las fuerzas utilizadas fueron de gravedad específica 1.495, y menor. (Faraday, 1849, p. 213)
se puede estudiar que las cantidades de sustancias descompuestas por acción de una cantidad de electricidad es siempre la misma, no importa la variación en el tamaño de los electrodos, ni la clase de electrolitos o la concentración de los mismos, solo depende de la naturaleza de la sustancia y la magnitud de la corriente eléctrica.
Para estudiar si existe alguna relación entre el tamaño de los electrodos, el cambio de las sustancias y la intensidad de corriente, se usan pares de electrodos de carbono de diferente grosor que se sumergen en la solución del electrolito, en este caso se usa cloruro de sodio en concentración de 1,0 Molar. Cada uno de los electrodos deben conectarse por medio de cables caimán a una fuente o pila de 9 Voltios, durante 5 minutos. Se observan dos tipos de efectos, uno en cada electrodo: producción de burbujeo en uno de los electrodos y desgaste del otro electrodo. No se observan distinción en estos efectos si los electrodos son gruesos o delgados.
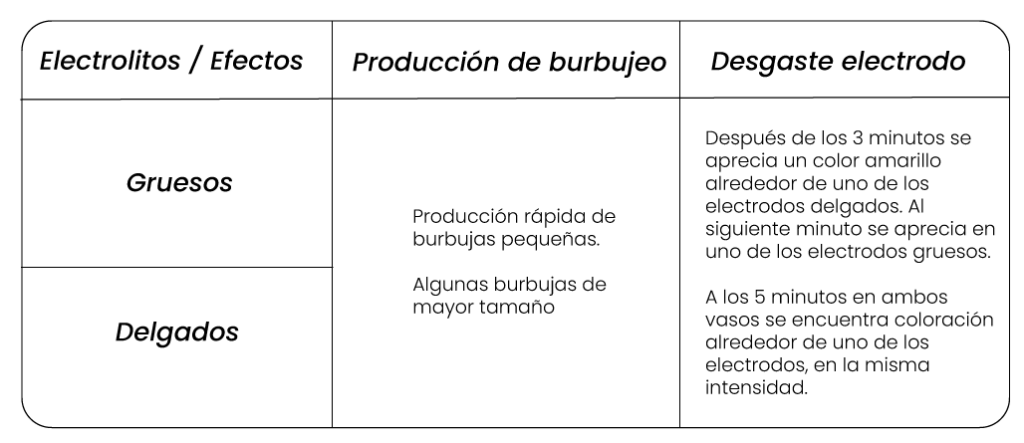
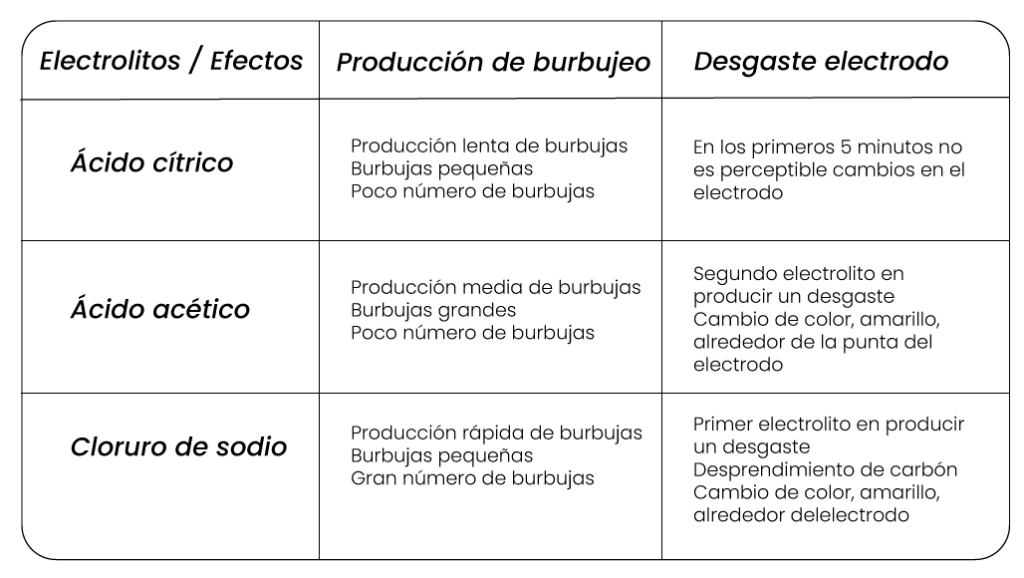
El estudio de la relación entre la intensidad de corriente, los cambios químicos y la clase de electrolitos se utilizan soluciones de ácido acético, ácido clorhídrico y cloruro de sodio, todas a una concentración de 1,0 Molar. Se usan electrodos de carbono del mismo tamaño y una fuente de 9 voltios. Inicialmente se sumergen los electrodos en la solución de ácido acético y se conectan con la fuente por medio de los cables caimán, durante un periodo de tiempo de 5 minutos. Este procedimiento se realizará utilizando cada solución de electrolitos.
Se observan dos tipos de efectos, uno en cada electrodo: producción de burbujeo en uno de los electrodos y desgaste del otro electrodo. La intensidad de estos efectos depende del tipo de electrolito.
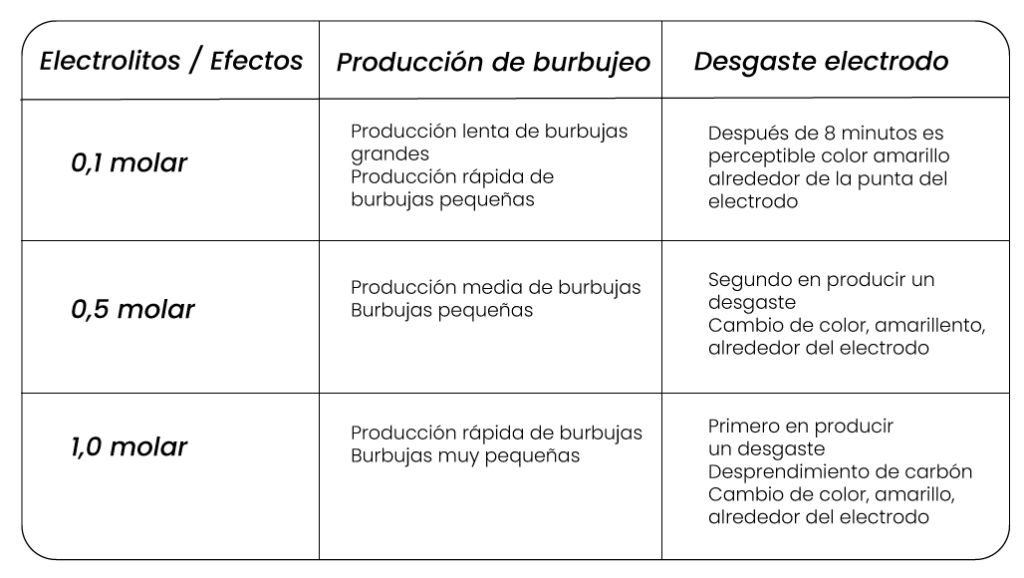
Sobre la relación entre la concentración del electrolito y la descomposición de las sustancias por acción de la corriente eléctrica se emplea una solución de ácido clorhídrico de concentración de 1,00 Molar, 0,50 Molar y 0,01 Molar de ácido clorhídrico, como electrodos se usan electrodos de carbono de igual tamaño, los cuales se sumergen en cada solución de diferente concentración y se conectan a una fuente por un tiempo de 5 minutos.
Se observan los siguientes efectos:
Sugerencias para las actividades experimentales
Les proponemos que utilizando una cuba electrolítica se proceda a examinar la influencia de los diferentes factores que consideran influyen en la descomposición de las sustancias con el paso de una corriente eléctrica.
- Se pueden recoger las sustancias depositadas en los electrodos y analizar la relación con la clase de electrolito utilizado
- De ser posible, medir las cantidades de sustancias depositadas o liberadas en cada uno de los electrodos y relacionarla con la magnitud de la corriente eléctrica que circula.
- Utilizar diferentes electrolitos, ¿hay alguno que no se descomponga por el paso de la corriente eléctrica? ¿qué pasaría en este caso con la corriente? ¿seria posible lograr la descomposición, en tal caso, si se aumenta la diferencia de potencial de la batería que se conecta?

Referencias bibliográficas

Dirección: Calle 72 No. 11-86, Bogotá, Colombia.
Código Postal: 110221
Horario de Atención: Lunes a viernes de 8:00 a.m. a 5:00 p.m.
Conmutador: (57) 601 348 5300
Nit: 899.999.124-4
Radicación de correspondencia:
archivogeneralupn@pedagogica.edu.co
Sistema PQRSFD:
Crear y/o consultar estado radicación
Inscribirse a nuestros programas académicos:
Admisiones y Registro
sub_admisiones@pedagogica.edu.co
Inscribirse a nuestros cursos de idiomas:
Centro de Lenguas
Únicamente notificaciones judiciales:
oju@pedagogica.edu.co
Comunicarse con nosotros:
Directorio digital
Direccion: Calle 72 No. 12-77
Horario: Lunes a viernes 8:00 a.m. - 4:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 468
Correo: sub_admisiones@pedagogica.edu.co
Direccion: Calle 79 n.º 16-32
Horario: Lunes a viernes 7:00 a.m. - 7:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 204 ext. 674
Direccion: Calle 39 n.º 1-60 Este - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 245 8684 ext. 618
Direccion: Calle 78 n.º 9-92 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 614 // 601 346 5786 ext. 114
Correo: fba@pedagogica.edu.co
Direccion: Carrera 22 n.º 73 - 43 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 255 5609
Direccion: Calle 183 n.º 54D-20 esquina - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 exts. 616 y 617 // 601 678 8888 - 601 678 8867 exts. 101, 102 y 128
Correo: fac.edufisica@pedagogica.edu.co
Direccion: Calle 127 n.º 11 – 20 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 627 6927 // 601 627 6928
Correo: ipn@pedagogica.edu.co