Actualizado en Octubre de 2024
Participan:
Sandra Sandoval Osorio, Liliana Tarazona Vargas, José Francisco Malagón Sánchez.
Colaboradoras: Jeimy Stephania Bernal Rubiano y Aura Daniela Rincón Camargo
Primera versión elaborada en mayo de 2022 con la participacion ademas de la profesora Marina Garzón Barrios
Arrhenius investiga la conductividad de los electrolitos y su relación con la concentración y la temperatura, y llega a la conclusión que:
Las soluciones contienen dos tipos diferentes de moléculas, de las cuales una es conductora y la otra no conductora de la electricidad como consecuencia de las propiedades atribuidas por la hipótesis de Gay-Lussac, Williamson y Clausius. Este último tipo fue llamado simplemente moléculas activas. El número de moléculas activas se incrementa con la dilución y a expensas de las inactivas que tienden a un límite, que probablemente se alcanza primero cuando todas las moléculas inactivas han sido transformadas en activas. (Arrhenius, 1912, p. 108)
Arrhenius escribe:
La conductividad de los diferentes iones depende del disolvente y de su temperatura. Un aumento de la temperatura aumenta la conductividad, de modo que la del ión menos conductor aumenta en mayor proporción que la del mejor conductor, es decir, las diferentes conductividades se aproximan entre sí con el aumento de la temperatura. (Arrhenius, 1912, p. 134).
Arrhenius, a través de los experimentos desarrollados por Noyes y sus estudiantes, establece que el aumento de la temperatura aumenta la conductividad eléctrica pero que los iones que conducen menos aumentan en mayor proporción que en el caso de los iones que conducen más, esto significa que a temperaturas altas las conductividades de todas estas sustancias electrolíticas se van a aproximar.
Estas observaciones son congruentes además con otra observación, en general, la conductividad en los compuestos orgánicos decrece con el incremento del número de átomos que contiene el ión, como fue indicado por Ostwald y Bredig (Arrhenius, pág. 134). Nótese como los valores en la conductividad del ión potasio K son siempre superiores a los valores de CH3CO2 cuando se encuentran a la misma temperatura.
Cabe señalar que resulta bastante interesante, que este comportamiento de la conductividad en las soluciones diluidas, es diferente al comportamiento que se puede observar en los conductores sólidos; en los conductores sólidos se reconoce que cuando aumenta la temperatura disminuye su conductividad, o, en otras palabras, se aumenta su resistencia eléctrica, y viceversa, al aumentar la temperatura de estos conductores su conductividad disminuye.
Sin embargo, en relación con la análoga que hacen Arrhenius y Van’t Hoff con las sustancias gaseosas, va a ser un caso importante de estudiar la electrificación en gases, pues hasta el momento se puede considerar que el efecto de ionización que estos sufren es posible cuando los gases han disminuido considerablemente su densidad, con el efecto que conlleva en la disminución de la temperatura.
Es posible que estas diferencias estén vinculadas con otras relaciones derivadas de los trabajos que Arrhenius ha estudiado, una de ellas es que la conductividad aumenta de forma con el aumento de la fluidez de las soluciones electrolíticas.
Pero no se puede pasar por alto, que pese a las regularidades que se han descrito para diversas sustancias electrolíticas, se aprecian diversas anomalías en el comportamiento de muchos electrolitos fuertes, que solo se pueden asociar con la clase de sustancia con la que se está tratando.
Se aprecia que la conductividad eléctrica se constituye en una problemática de estudio bastante amplía. Intentar dar cuenta de la conductividad eléctrica, en general, y la conductividad en sólidos, líquidos o gases, responde a las preguntas: ¿cómo se comportan las sustancias frente al paso de electricidad? ¿y qué es la electricidad en relación con esas sustancias que logran ser afectadas?
La disociación de sustancias en solución, que contribuye a la teoría de los iones libres, logra una gran síntesis en la comprensión de estos aspectos. Una hipótesis es que una cantidad de sustancia es portadora de una cantidad de electricidad que al moverse a través de un medio es responsable de convertirle en un medio conductor de la electricidad.
Sugerencias para las actividades experimentales
En el trabajo experimental podemos estudiar la variación de la conductividad de soluciones tales como sales orgánicas e inorgánicas, ácidos fuertes y débiles, con la variación de temperatura.
Se recomienda desarrollar un montaje en el cual las variaciones se hagan en un rango de temperatura de 20° a 90° C. Pero debemos advertir que la fluidez de las soluciones también debe ser tenido en cuenta, porque en aquellos casos en los cuales la fluidez se ve afectada con la temperatura se pueden dar comportamientos anormales que los interesados pueden estudiar.
Adicionalmente Arrhenius termina haciendo alusión con las soluciones no acuosas y donde podemos preguntarnos si las mismas leyes de la teoría de la disociación son válidas para estas soluciones.
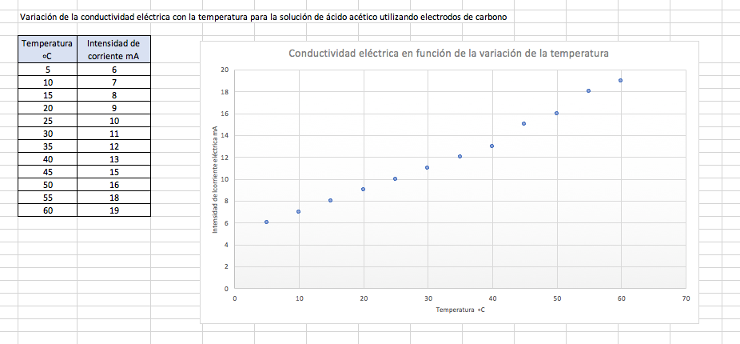
A continuación, presentamos los datos de variación de la intensidad de corriente a diferentes temperaturas, para una solución de ácido acético. Se pueden hacer gráficas y tablas similares para otros electrolitos, ¿considera que las gráficas que se obtendrían todas tendrían la misma forma? Es decir ¿en todos los casos se puede llegar resultados similares a los que encontramos aquí?
Referencias bibliográficas

Dirección: Calle 72 No. 11-86, Bogotá, Colombia.
Código Postal: 110221
Horario de Atención: Lunes a viernes de 8:00 a.m. a 5:00 p.m.
Conmutador: (57) 601 348 5300
Nit: 899.999.124-4
Radicación de correspondencia:
archivogeneralupn@pedagogica.edu.co
Sistema PQRSFD:
Crear y/o consultar estado radicación
Inscribirse a nuestros programas académicos:
Admisiones y Registro
sub_admisiones@pedagogica.edu.co
Inscribirse a nuestros cursos de idiomas:
Centro de Lenguas
Únicamente notificaciones judiciales:
oju@pedagogica.edu.co
Comunicarse con nosotros:
Directorio digital
Direccion: Calle 72 No. 12-77
Horario: Lunes a viernes 8:00 a.m. - 4:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 468
Correo: sub_admisiones@pedagogica.edu.co
Direccion: Calle 79 n.º 16-32
Horario: Lunes a viernes 7:00 a.m. - 7:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 204 ext. 674
Direccion: Calle 39 n.º 1-60 Este - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 245 8684 ext. 618
Direccion: Calle 78 n.º 9-92 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 614 // 601 346 5786 ext. 114
Correo: fba@pedagogica.edu.co
Direccion: Carrera 22 n.º 73 - 43 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 255 5609
Direccion: Calle 183 n.º 54D-20 esquina - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 exts. 616 y 617 // 601 678 8888 - 601 678 8867 exts. 101, 102 y 128
Correo: fac.edufisica@pedagogica.edu.co
Direccion: Calle 127 n.º 11 – 20 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 627 6927 // 601 627 6928
Correo: ipn@pedagogica.edu.co