Actualizado en Octubre de 2024
Participan:
Sandra Sandoval Osorio, Liliana Tarazona Vargas, José Francisco Malagón Sánchez.
Colaboradoras: Jeimy Stephania Bernal Rubiano y Aura Daniela Rincón Camargo
Primera versión elaborada en mayo de 2022 con la participacion ademas de la profesora Marina Garzón Barrios
Arrhenius estudia cómo la concentración de la solución y la temperatura influyen en la conductividad de las soluciones. En el primer caso, la variable concentración. Arrhenius muestra que la conductividad de las soluciones aumenta cuando aumenta el grado de dilución, pero no infinitamente:

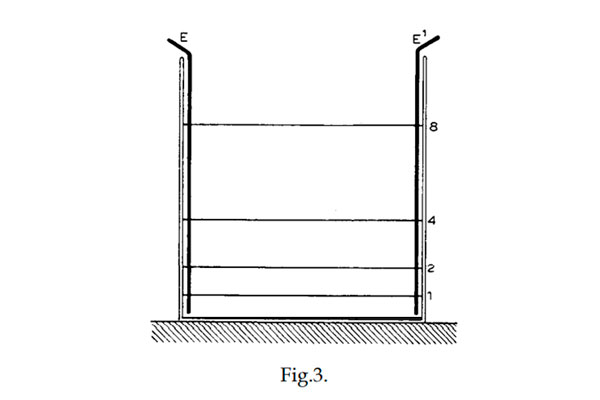
En 1884 presenté un trabajo sobre este tema. Había encontrado que si una solución de, por ejemplo, sulfato de zinc se diluye, su conductividad por molécula, o lo que se denomina conductancia molar, no aumenta infinitamente, sino sólo hasta un cierto límite. Podemos visualizar un experimento realizado de la siguiente manera (Fig. 3).
En un recipiente de paredes paralelas se insertan muy cerca de dos lados opuestos dos placas de zinc amalgamado, E y E'. Se introduce una capa de solución de sulfato de zinc que se extiende desde el fondo horizontal del recipiente hasta la línea 1. Se supone que la conductividad es ahora k1. Después de medirla, se añade suficiente agua para que, después de agitar la solución, el nivel llegue a 2, que está tan por encima de 1 como 1 del fondo. Se comprueba que la conductividad ha aumentado y tiene un valor k2. Cuando se duplica el volumen de la misma manera mediante la adición de agua pura, se alcanza el nivel 4 y la conductividad es mayor que en el caso anterior, digamos k4. Podemos continuar así y la conductividad aumenta, pero finalmente a un ritmo menor que al principio. Se alcanza así un valor final de k∞. (Arrhenius, 1903, p. 49)
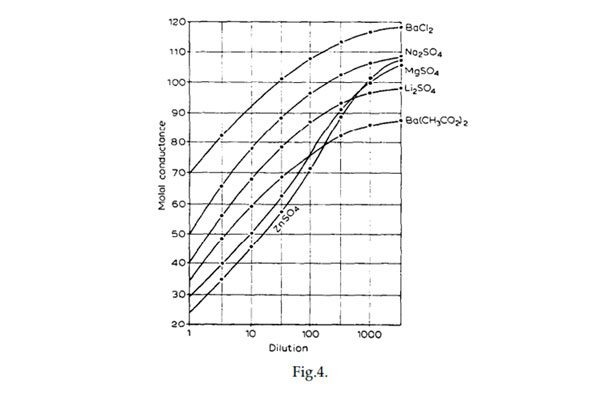
La variación de la conductividad con respecto a diferentes sales tiende a hacerse constante en la medida en que disminuye la concentración de la disolución y Arrhenius explica este aspecto por la velocidad de transferencia de los iones implicados en la solución la cual depende de la diferencia de potencial entre E y E’. Sin embargo, si la diferencia de potencial es la misma para todas las sales, entonces la variable de la cual depende el cambio de la conductancia con el cambio de la dilución de la solución, se debe a la clase de sustancias y de iones en los cuales se disocia. (Diferentes casos son presentados en la figura 4).
Por último, se destaca que Arrhenius afirma que:
… la actividad química coincide con la actividad eléctrica. El agua, los alcoholes, los fenoles, los aldehídos, etc., que intercambian iones con los electrolitos son también electrolitos. (Arrhenius, 1903, p. 109)
Sugerencias para las actividades experimentales
En este caso se puede examinar la variación de la conductividad en soluciones de diferentes clases de sustancias: Ácidos fuertes y débiles, diferentes sales o diferentes hidróxidos.
Al mantener la distancia, clase y tamaño de los electrodos en una cuba electrolítica y modificar la concentración de las soluciones, haciéndolas cada vez mas diluidas, podemos examinar el cambio que se presenta.
Es posible analizar ¿por qué en todos los electrolitos no cambia de la misma manera la conductividad de las sustancias con la variación de la concentración de las mismas? Si nos atenemos a la hipótesis de las fracciones de moléculas activas Vs las inactivas ¿Cuáles clases de sustancias presentan mayor fracción de moléculas activas? ¿En qué clase de sustancias crece más la conductividad con la dilución? Estas distintas ordenaciones de los resultados experimentales son útiles para comenzar a argumentar la relación de la que nos hablan estos científicos entre la electricidad y la actividad de las sustancias.
En una celda electrolítica se disponen placas de cobre en medio de una solución de cloruro de sodio. Las placas se conectan a una batería generando una diferencia de potencial constante. El electrolito se va diluyendo añadiendo agua, cada vez que se agregan 20 mL de agua se registra la corriente eléctrica en el amperímetro. Esta misma disposición se puede realizar con pares de metales de zinc.
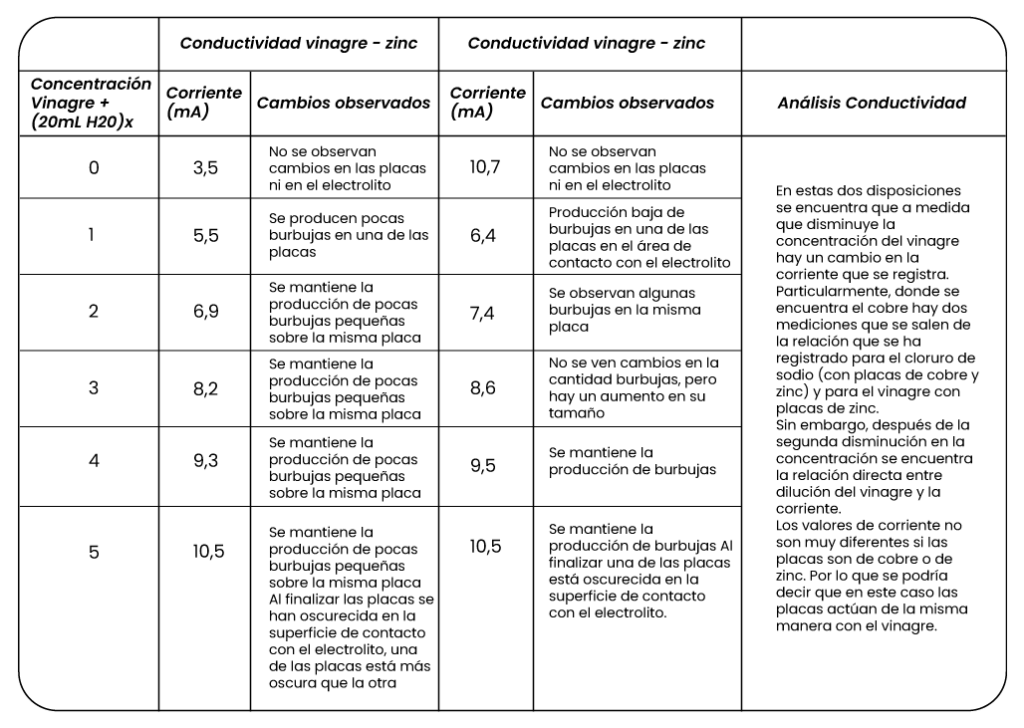

Ahora se disponen los mismos metales utilizados en la anterior situación, pero se estudia la conductividad cuando el electrolito es vinagre y el efecto que tiene su dilución.
Referencias bibliográficas

Dirección: Calle 72 No. 11-86, Bogotá, Colombia.
Código Postal: 110221
Horario de Atención: Lunes a viernes de 8:00 a.m. a 5:00 p.m.
Conmutador: (57) 601 348 5300
Nit: 899.999.124-4
Radicación de correspondencia:
archivogeneralupn@pedagogica.edu.co
Sistema PQRSFD:
Crear y/o consultar estado radicación
Inscribirse a nuestros programas académicos:
Admisiones y Registro
sub_admisiones@pedagogica.edu.co
Inscribirse a nuestros cursos de idiomas:
Centro de Lenguas
Únicamente notificaciones judiciales:
oju@pedagogica.edu.co
Comunicarse con nosotros:
Directorio digital
Direccion: Calle 72 No. 12-77
Horario: Lunes a viernes 8:00 a.m. - 4:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 468
Correo: sub_admisiones@pedagogica.edu.co
Direccion: Calle 79 n.º 16-32
Horario: Lunes a viernes 7:00 a.m. - 7:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 204 ext. 674
Direccion: Calle 39 n.º 1-60 Este - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 245 8684 ext. 618
Direccion: Calle 78 n.º 9-92 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 614 // 601 346 5786 ext. 114
Correo: fba@pedagogica.edu.co
Direccion: Carrera 22 n.º 73 - 43 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 255 5609
Direccion: Calle 183 n.º 54D-20 esquina - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 exts. 616 y 617 // 601 678 8888 - 601 678 8867 exts. 101, 102 y 128
Correo: fac.edufisica@pedagogica.edu.co
Direccion: Calle 127 n.º 11 – 20 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 627 6927 // 601 627 6928
Correo: ipn@pedagogica.edu.co