Elaborado en Mayo 2022
Participan:
Sandra Sandoval Osorio, Liliana Tarazona Vargas, José Francisco Malagón Sánchez y Marina Garzón Barrios.
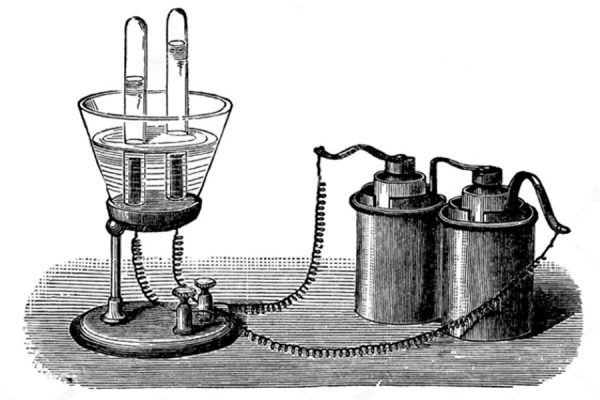
En esta parte se presenta el electrovoltámetro, como un instrumento de medida que pasa a ocupar un lugar destacado en las investigaciones de Faraday para poder relacionar las cantidades de sustancia descompuestas con las cantidades de electricidad involucradas. Podemos describir uno de ellos:
El tubo se dobla en el centro; un extremo está cerrado; en ese extremo se fija un alambre y una placa “a”, introduciéndolo hacia abajo, como se muestra en la figura (fig 23), que estará lo más cerca posible del ángulo del doblez, de tal manera que en el extremo cerrado del tubo, se recoja todo el gas que se produzca en él. El plano de esta placa también es perpendicular. La otra terminación metálica “b”, se introduce en el momento en que la descomposición se produce, acercándose lo más posible al ángulo, sin producir ningún gas que pase a través de él hacia el extremo cerrado del instrumento. El gas que se ha producido se deja escapar. (Faraday, 1849, p. 208)
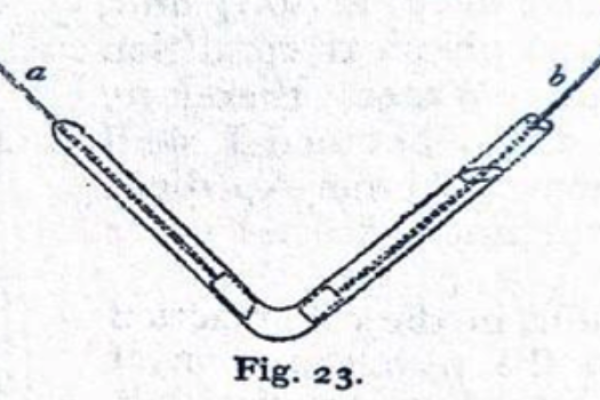
Nos detenemos en este aspecto, para reiterar que los instrumentos son fruto de las concepciones conceptuales, de las preguntas, de las formas de comprender y de mostrar los efectos que queremos caracterizar y cuantificar. En la construcción de los voltaelectometros como el que se ha descrito anteriormente, se deben tomar precauciones para que los gases que se producen en los electrodos positivo y negativo, no se recombinen o se mezclen, los alambres o hilos metálicos deben ser aislados para que no produzcan efectos colaterales en la solución, de tal manera que se asegure que toda la electricidad que pasa a través de cada uno de ellos también será transmitida a otro. (Faraday, 1849, p. 209)
Los tamaños, las formas de las placas de los electrodos también son estudiadas en detalle, hasta estabilizar la mejor disposición de los mismos para el propósito de medir la cantidad de electricidad que pasa en un tiempo igual capaz de descomponer cantidades iguales de sustancia, teniendo como referente un mismo volumen siempre de gas hidrógeno. De este trabajo, también se deduce que la variación en el tamaño de los electrodos no causa variación en la acción química de una cantidad dada de electricidad sobre el agua. (Faraday, 1849: 212). Sucesivamente, se acude a diferentes montajes para estudiar la influencia de la solubilidad de los gases producidos en las soluciones, el efecto de la variación de la intensidad de la corriente eléctrica que atraviesa los conductores y el efecto de la variación de la fuerza de la solución que se utiliza para lo cual se agregan varios ácidos fuertes, sales o hidróxidos. Al finalizar no solo se establecen las condiciones en las cuales no importa el tamaño de los electrodos, o la concentración de las sustancias disueltas en el agua o la variación en la intensidad de la corriente eléctrica para poder afirmar:
El principio muy extraordinario e importante con respecto al AGUA, que cuando se somete a la influencia de la corriente eléctrica, una cantidad de la misma se descompone exactamente proporcional a la cantidad de electricidad que ha pasado, a pesar de las mil variaciones en las condiciones y circunstancias bajo las cuales puede ser colocada en ese momento; y más aún, cuando se protege contra la interferencia de ciertos efectos secundarios (742). &c.), junto con la solución o recombinación del gas y la producción del aire, los productos de la descomposición pueden ser recolectados con tal exactitud, que permiten una medición excelente y valiosa de la electricidad involucrada en su producción. (Faraday, 1849, p. 215)
Además, se garantiza que el instrumento establece con exactitud la acción electroquímica que se ha generado. Y por último, llega a estudiar y distinguir entre efectos primarios y secundarios, los efectos primarios son debidos a la acción de las corrientes sobre las sustancias en la solución, es el caso de la producción de oxígeno e hidrógeno en la electrolisis del agua. Ahora los efectos secundarios son debidos a interacciones entre las sustancias que aparecen en el proceso independiente de la corriente. Faraday establece dos casos: Unas acciones entre las sustancias producidas como efectos primarios y los electrodos o de las sustancias producidas como efecto primario y las sustancias contenidas en el electrolito. Por ejemplo, cuando el electrodo positivo es de carbono en ácido sulfúrico diluido, óxido y ácido carbónico aparecen allí ocasionalmente en vez de oxígeno, esto quiere decir que el oxígeno reacciona con el carbono del electrodo y con el agua del electrolito para darnos los productos mencionados.
por ejemplo, contamos con un electrodo positivo de platino en una solución de nitrato o acetato de plomo, entonces aparece peróxido de plomo, que es un efecto secundario, pero debido a una acción del oxígeno sobre la sustancia de la solución. (Faraday, 1849: 134)
son fundamentales para establecer las medidas de referencia que se usaran en los electrovoltámetros, pues sin estas no sería posible garantizar la unidad de medida.
la riqueza de estos trabajos no solo radica en la formulación final de las leyes de Faraday, que son las que mejor expresan la equivalencia entre la cantidad de sustancia transformada y la cantidad de electricidad que pasa a través de la solución en un tiempo determinado. Además de ello los trabajos teóricos experimentales son fundamentales para comprender y desarrollar necesariamente una mirada conceptual sobre estos procesos, una formulación de la teoría de los iones que se logra al final.
Una bureta llena de solución acidulada con acido sulfúrico ha sido invertida en un beaker con la misma solución. Luego se han dispuesto adecuadamente los electrodos y se han medido los volúmenes de hidrógeno producido, en diferentes tiempos. De tal manera que se obtienen los resultados que presentamos en la siguiente tabla y de hay podemos graficar la cantidad de hidrógeno producido en relación con la cantidad de electricidad (carga eléctrica)
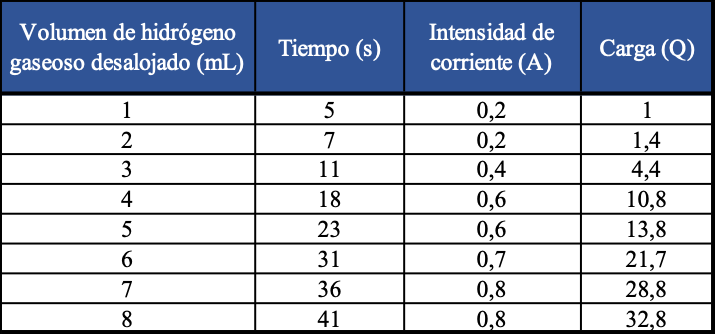
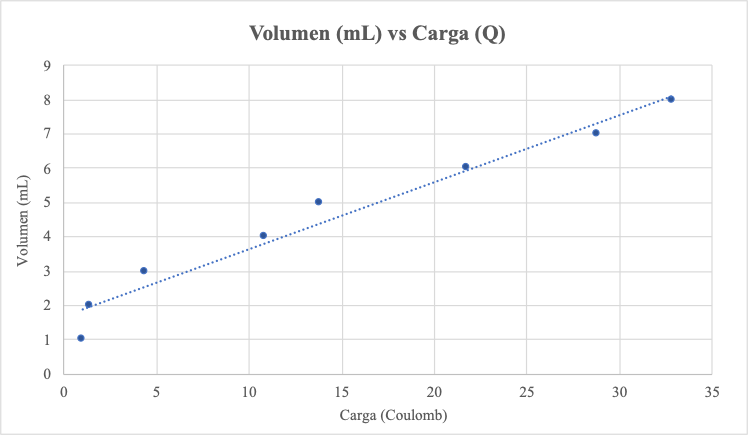
Esta misma disposición experimental puede ser utilizada para otras soluciones de electrolitos e idear formas de medir la cantidad de sustancia producida en relación con la carga eléctrica y llegar a elaboraciones que expliquen los diferentes casos.
Sugerencias para las actividades experimentales
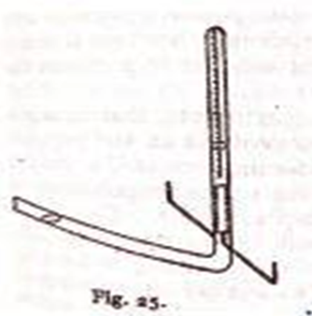
A partir de las descripciones hechas por Faraday de su electrovoltámetro se puede tomar un tubo en V y con los las debidas precauciones y adaptaciones medir la cantidad de hidrógeno que se libera por unidad de tiempo cuando una cantidad determinada de electricidad fluye por el medio. Tal como se muestra en la imagen adjunta.
Cuando se hace la electrólisis de diferentes sustancias alcalinas, ácidas o sales, registrar las observaciones de efectos secundarios que se dan ¿cómo se explican estos efectos?
Si se contabiliza la cantidad de sustancias que se producen en estos casos con la misma cantidad de sustancia y el mismo tiempo, es posible hallar relaciones entre las distintas cantidades de sustancias que es lo que hemos denominado electroequivalentes químicos.
Referencias bibliográficas

Dirección: Calle 72 No. 11-86, Bogotá, Colombia.
Código Postal: 110221
Horario de Atención: Lunes a viernes de 8:00 a.m. a 5:00 p.m.
Conmutador: (57) 601 916 9999
Nit: 899.999.124-4
Radicación de correspondencia:
archivogeneralupn@pedagogica.edu.co
Sistema PQRSFD:
Crear y/o consultar estado radicación
Inscribirse a nuestros programas académicos:
Admisiones y Registro
sub_admisiones@pedagogica.edu.co
Inscribirse a nuestros cursos de idiomas:
Centro de Lenguas
Únicamente notificaciones judiciales:
oju@pedagogica.edu.co
Comunicarse con nosotros:
Directorio digital
Direccion: Calle 72 No. 12-77
Horario: Lunes a viernes 8:00 a.m. - 4:00 p.m. - Jornada continua
Teléfono: (57) 601 916 9999 ext. 468
Correo: sub_admisiones@pedagogica.edu.co
Direccion: Calle 79 n.º 16-32
Horario: Lunes a viernes 7:00 a.m. - 7:00 p.m. - Jornada continua
Teléfono: (57) 601 916 9999 ext. 204 ext. 674
Direccion: Calle 39 n.º 1-60 Este - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 245 8684 ext. 618
Direccion: Calle 78 n.º 9-92 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 916 9999 ext. 614 // 601 346 5786 ext. 114
Correo: fba@pedagogica.edu.co
Direccion: Carrera 22 n.º 73 - 43 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 255 5609
Direccion: Calle 183 n.º 54D-20 esquina - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 916 9999 exts. 616 y 617 // 601 678 8888 - 601 678 8867 exts. 101, 102 y 128
Correo: fac.edufisica@pedagogica.edu.co
Direccion: Calle 127 n.º 11 – 20 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 627 6927 // 601 627 6928
Correo: ipn@pedagogica.edu.co