Elaborado en Mayo 2022
Participan:
Sandra Sandoval Osorio, Liliana Tarazona Vargas, José Francisco Malagón Sánchez y Marina Garzón Barrios.
En esta parte destacamos que Faraday establece que es la corriente la causa de la descomposición de las sustancias que ésta atraviesa, más que la acción de los polos. Los polos serán el límite entre el electrolito y el camino por donde entra y sale la corriente eléctrica. La corriente modifica la afinidad química entre los componentes del electrolito y siempre que haya otros componentes con los cuales recombinarse se dará el proceso de descomposición. Así la producción de metales o sales en los polos se debe a la presencia de otras sustancias con las que son afines, igualmente pasa en el caso de los gases que se liberan, los ácidos y álcalis que quedan en el fluido que rodea los polos. (la explicación de la descomposición por la atracción de los polos no da cuenta de estos casos en los que las sustancias no quedan unidas a los polos) (Faraday, 1849, p. 151) Otro aspecto que se deriva de esta explicación es que si la afinidad de los componentes de la sustancia es muy fuerte la corriente producida por la pila no podrá descomponerlo.
Supongo que los efectos se deben a una modificación, por la corriente eléctrica, de la afinidad química de las partículas a través de las cuales pasa esa corriente, lo que les da el poder de actuar con mayor fuerza en una dirección que en otra, y consecuentemente ellos viajan por una serie de descomposiciones y recomposiciones sucesivas en direcciones opuestas, y finalmente causan su expulsión o exclusión en los límites del cuerpo bajo descomposición (…) No creo que una sustancia pueda transferirse en la corriente eléctrica más allá del punto donde deja de encontrar partículas con las que puede combinarse. (Faraday, 1849, p.151)
Otro aspecto que se deriva de esta explicación es que si la afinidad de los componentes de la sustancia es muy fuerte la corriente producida por la pila no podrá descomponerlo. En caso contrario, la capacidad del electrolito de sufrir descomposición está vinculada con la capacidad de conducir electricidad. Faraday lo expresa de la siguiente manera:
La conclusión es casi irresistible, que en los electrolitos el poder de transmitir la electricidad a través de la sustancia depende de la capacidad de sufrir descomposición; teniendo lugar solo mientras se están descomponiendo y siendo proporcional a la cantidad de elementos separados. (Faraday, 1849, p. 201)
Sugerencias para las actividades experimentales
Se puede hacer uso de agua pura para tratar de generar una corriente a través de ella. Estudiemos qué pasa si vamos aumentando el numero de baterías o si desde una fuente de voltaje aumentamos la diferencia de potencial.
Ahora disolviendo una sal, ácido o hidróxido, hacer el proceso anterior ¿Qué diferencias se observan? ¿Cómo se pueden explicar?
Cómo se podría indagar qué sucede en el seno del electrolito cuando circula la corriente eléctrica? ¿Se puede analizar la descomposición de la sustancia en este lugar?
¿Qué sucede si se varia la distancia entre los electrodos? ¿Qué sucede con el electrolito que queda atrás de los electrodos?
Si la corriente aumenta, ¿Qué pasa en relación con los cambios químicos del electrolito?
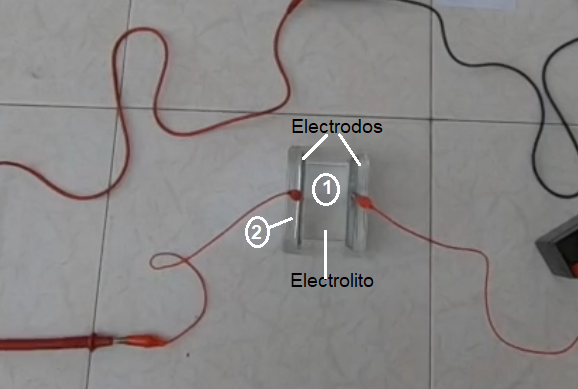
1 ¿Qué puede estar sucediendo en esta región 1? En el seno del electrolito?
2 ¿ que pasa con el electrolito en esta región 2? Detrás del electrodo?
3. ¿ Qué podemos suponer que acontece si se cambia la distancia entre los electrodos?
Referencias bibliográficas

Dirección: Calle 72 No. 11-86, Bogotá, Colombia.
Código Postal: 110221
Horario de Atención: Lunes a viernes de 8:00 a.m. a 5:00 p.m.
Conmutador: (57) 601 348 5300
Nit: 899.999.124-4
Radicación de correspondencia:
archivogeneralupn@pedagogica.edu.co
Sistema PQRSFD:
Crear y/o consultar estado radicación
Inscribirse a nuestros programas académicos:
Admisiones y Registro
sub_admisiones@pedagogica.edu.co
Inscribirse a nuestros cursos de idiomas:
Centro de Lenguas
Únicamente notificaciones judiciales:
oju@pedagogica.edu.co
Comunicarse con nosotros:
Directorio digital
Direccion: Calle 72 No. 12-77
Horario: Lunes a viernes 8:00 a.m. - 4:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 468
Correo: sub_admisiones@pedagogica.edu.co
Direccion: Calle 79 n.º 16-32
Horario: Lunes a viernes 7:00 a.m. - 7:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 204 ext. 674
Direccion: Calle 39 n.º 1-60 Este - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 245 8684 ext. 618
Direccion: Calle 78 n.º 9-92 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 ext. 614 // 601 346 5786 ext. 114
Correo: fba@pedagogica.edu.co
Direccion: Carrera 22 n.º 73 - 43 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 255 5609
Direccion: Calle 183 n.º 54D-20 esquina - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 348 5300 exts. 616 y 617 // 601 678 8888 - 601 678 8867 exts. 101, 102 y 128
Correo: fac.edufisica@pedagogica.edu.co
Direccion: Calle 127 n.º 11 – 20 - Bogotá D.C.
Horario: Lunes a viernes 8:00 a.m. - 5:00 p.m. - Jornada continua
Teléfono: (57) 601 627 6927 // 601 627 6928
Correo: ipn@pedagogica.edu.co